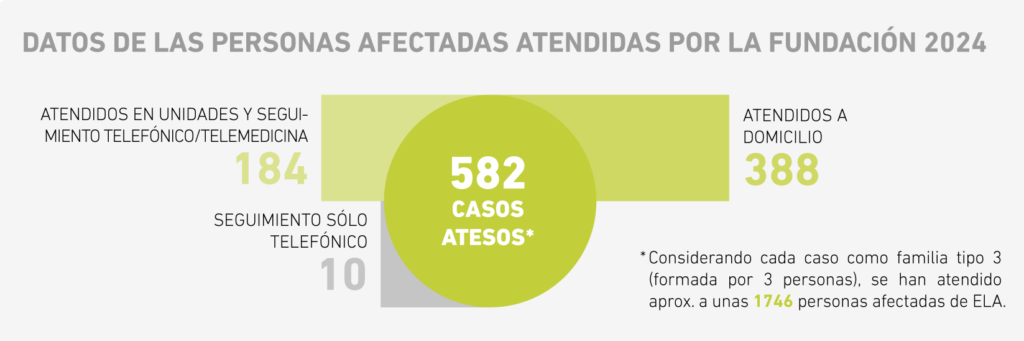
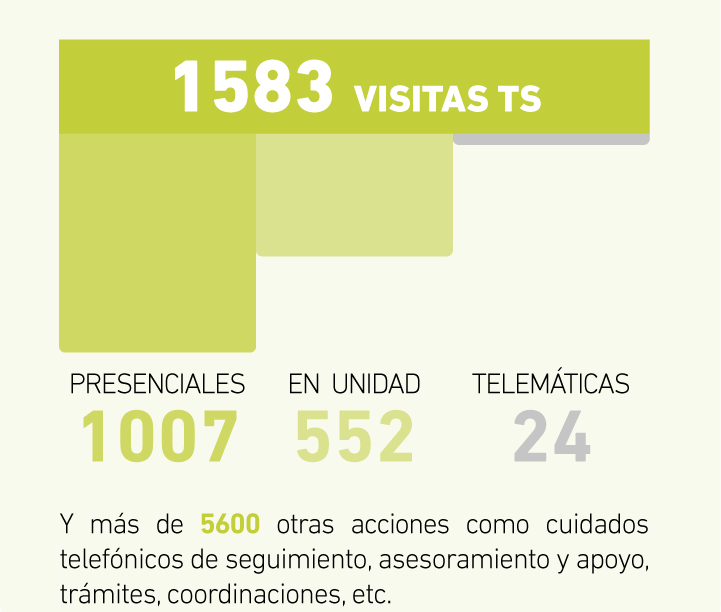
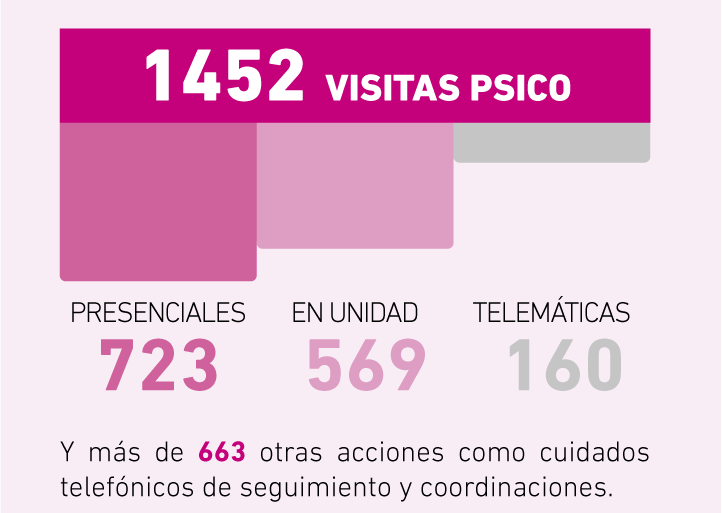
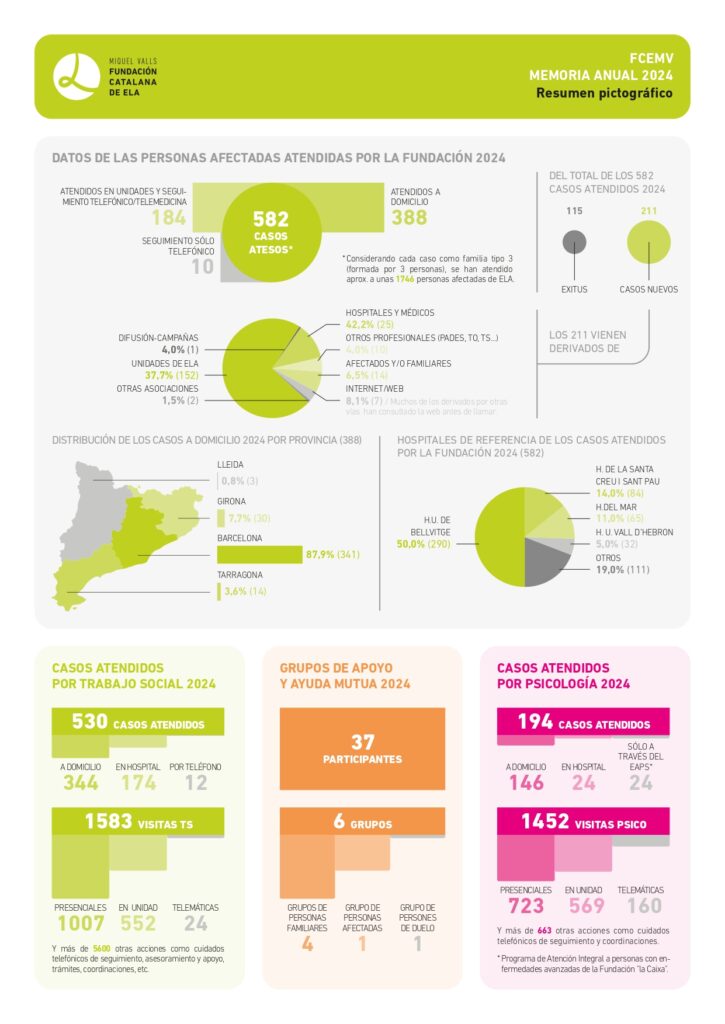
El equipo de trabajo social de la Fundació Catalana d’ELA Miquel Valls acompaña, orienta y facilita herramientas a las personas afectadas de ELA en el proceso de reflexión y toma de decisiones a la hora de redactar y registrar el Documento de Voluntades Anticipadas (DVA). A continuación, te ofrecemos toda la información al respecto:
¿Qué es el DVA?
El Documento de Voluntades Anticipadas (DVA) es un documento dirigido al médico/a responsable, en el que el paciente (mayor de edad y con capacidad suficiente) da una serie de instrucciones u orientaciones sobre el tratamiento médico que puede recibir, o que no aceptaría, en caso de que no pueda expresar su voluntad. Es decir, el objetivo del DVA es garantizar el respeto a las decisiones personales de los pacientes en caso de que no puedan comunicarse de ninguna manera y/o no puedan entender ni decidir sobre la situación en la que se encuentran. De este modo, el DVA aumenta la seguridad tanto del paciente como de los profesionales sanitarios, asegurando que se respetará su voluntad en todo momento.
Cabe señalar que la redacción de un DVA, aunque recomendable, no es obligatoria en ningún caso. Reflexionar sobre situaciones futuras complejas y determinar nuestras preferencias puede ser difícil para algunas personas e, incluso, estas preferencias pueden cambiar a lo largo del tiempo y de la enfermedad. Por ello, además del DVA, existen otras herramientas para garantizar que los pacientes dispongan de la información y la ayuda necesarias para tomar las decisiones más adecuadas en cada momento de su enfermedad.
En este sentido, debemos conocer la Planificación de Decisiones Anticipadas (PDA), que es un proceso de diálogo entre la persona afectada (o sus representantes) y el profesional sanitario, en el que se toman decisiones concretas sobre eventos previsibles y específicos de la enfermedad. Estas dos herramientas son complementarias, y el hecho de contar con un DVA puede facilitar el proceso de PDA, ya que permite confirmar o modificar las preferencias previamente expresadas en el documento.
¿Por qué es importante hacer el DVA?
La realización del DVA cobra especial importancia en enfermedades como la ELA/Neurona Motora, en las que prever la evolución de los síntomas es muy complicado. No saber cómo ni cuándo avanzará la enfermedad genera incertidumbre y angustia tanto en la persona afectada como en sus familiares y amigos. En este sentido, dialogar con la persona afectada y plasmar sus preferencias en un documento proporciona tranquilidad tanto a quien toma las decisiones como a su entorno.
A nivel médico, los profesionales sanitarios también necesitan conocer la existencia de este documento, ya que pueden surgir crisis en las que, sin un DVA, los médicos no pueden actuar con rapidez, y la responsabilidad de tomar decisiones recae sobre la familia y/o amigos.
Para garantizar el respeto a la voluntad de la persona afectada, es importante saber que, mientras esta pueda comunicarse de cualquier forma y entender la información sobre su estado de salud y las opciones terapéuticas disponibles, podrá tomar decisiones diferentes a las que constan en el documento. En este caso, el DVA puede ser revocado o modificado en cualquier momento por voluntad del otorgante. Esta revocación debe hacerse de forma expresa y por escrito.
Puedes encontrar más información sobre la importancia del DVA en el siguiente artículo del blog de la Fundació Catalana d’ELA Miquel Valls: https://fundaciomiquelvalls.org/document-de-voluntats-anticipades-dva/
Contenido del DVA
No existe un modelo oficial de DVA, por lo que el contenido del documento es libre y no está estandarizado. Sin embargo, hay algunos modelos que pueden servir de guía, como los disponibles en la web de la Generalitat de Catalunya: https://web.gencat.cat/ca/tramits/tramits-temes/Inscripcio-al-Registre-de-voluntats-anticipades?category=&moda=1
Desde la Fundació Catalana d’ELA Miquel Valls también disponemos de un modelo específico que incluye diferentes medidas que pueden proponerse a lo largo de la enfermedad.
En cualquiera de estos modelos se pueden encontrar las siguientes secciones:
- Orientaciones generales: hacen referencia a valores personales que se desean preservar en situaciones clínicas, deseos y limitaciones que se quieren tener en cuenta en las decisiones, aunque no se refieran a situaciones concretas.
- Orientaciones y limitaciones concretas: se refieren a actuaciones específicas en el curso de enfermedades de evolución conocida, antes de intervenciones quirúrgicas, etc. Para que estas especificaciones sean lo más realistas posible, es recomendable solicitar la opinión de un profesional. También puedes consultar la herramienta de Decisiones Compartidas, que ofrece información sobre procesos terapéuticos y otros aspectos de la enfermedad: https://decisionscompartides.gencat.cat/ca/decidir-sobre/ela/.
- Nombramiento de un representante: es decir, la persona que, a partir de entonces, será el interlocutor de los profesionales sanitarios en cuestiones clínicas, por encima de familiares o allegados. Este representante dará o no el consentimiento informado y ayudará a interpretar la adecuación del DVA en cada caso, siempre que la persona afectada no pueda decidir por sí misma.
El DVA también puede incluir la voluntad de recibir la eutanasia si se cumplen las condiciones descritas en el documento, siempre que se cumplan los requisitos establecidos en la Ley Orgánica 3/2021. Es importante destacar que esta voluntad escrita no implica una solicitud formal, por lo que, en caso de querer iniciar el proceso de eutanasia, será necesario seguir el procedimiento correspondiente. Más información sobre esta opción en: https://canalsalut.gencat.cat/ca/vida-saludable/etapes-de-la-vida/final-vida/eutanasia/
Asimismo, el DVA puede reflejar la voluntad de donar órganos, tejido nervioso para la investigación científica o el cuerpo para la docencia, así como decisiones sobre entierro o incineración, entre otras. No obstante, algunas de estas consideraciones pueden no estar bajo la competencia de los médicos, por lo que será necesario acudir al profesional correspondiente para garantizar su cumplimiento.
Formalización y registro
Para que el DVA tenga validez, debe incluir los datos de identidad del otorgante, confirmar que es mayor de edad, que su capacidad no está alterada y que reconoce el contenido del documento como expresión de su voluntad. Para validar esta información, el documento debe firmarse bajo una de estas tres opciones:
- Ante notario.
- Ante tres testigos mayores de edad y con plena capacidad de obrar, de los cuales al menos dos no deben tener relación de parentesco hasta el segundo grado ni estar vinculados patrimonialmente con el otorgante.
- Ante un profesional sanitario.
Con esta firma, el DVA original ya será válido y no será necesario inscribirlo en el registro del Departament de Salut. Sin embargo, si se registra, el documento se incorporará a la historia clínica compartida de los pacientes y podrá consultarse y obtenerse una copia a través del apartado de Voluntades y Donaciones de “La Meva Salut”.
Para inscribir el DVA en el Registro de Voluntades Anticipadas, la forma más rápida es a través del CAP, aunque también se puede consultar en el hospital de referencia si ofrecen esta opción. Además de esta inscripción, si eres una persona afectada por la ELA, recomendamos presentar el DVA al médico responsable o a la unidad de ELA/Motoneurona en la que realizas el seguimiento, para que los profesionales conozcan la voluntad descrita y puedan incorporar el documento a tu historia clínica de forma visible.
También es importante que el DVA lo tengan los representantes, familiares y llevar siempre una copia contigo en caso de emergencia.
Si eres una familia afectada por la ELA atendida por la Fundación, puedes consultar con tu Trabajadora Social de referencia sobre este documento si aún no lo tienes.
Departamento de Trabajo Social de la Fundació Catalana d’ELA Miquel Valls